Potencial de Oxidação-Redução (ORP): Uma Explicação Mais Completa
#PotencialDeOxidaçãoRedução #ORP #OxidaçãoRedução #EquilíbrioRedox #SaúdeORP
Instituto Hidrogênio Molecular
2/15/20253 min ler
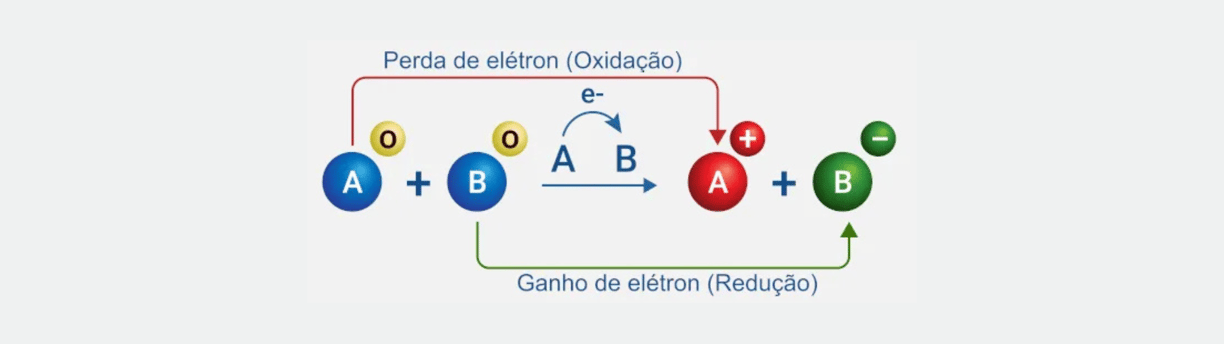
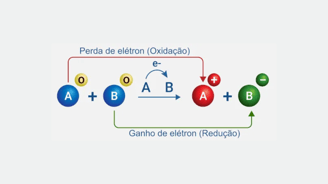
MEIAS-REAÇÕES
Conforme explicado anteriormente , o ORP é medido em volts e nos informa sobre o potencial de oxidação ou redução de uma solução. 1 Uma sonda de ORP mede a diferença de voltagem entre pares redox de acordo com suas meias reações 2 (veja a tabela 17.1 abaixo).
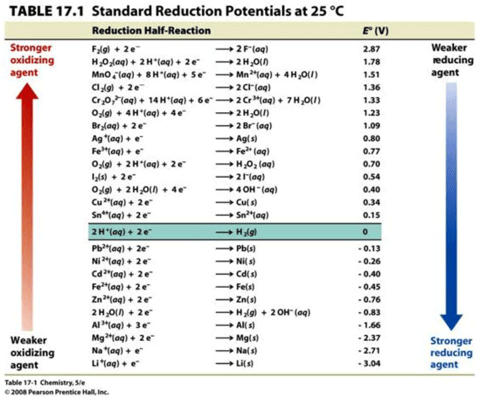
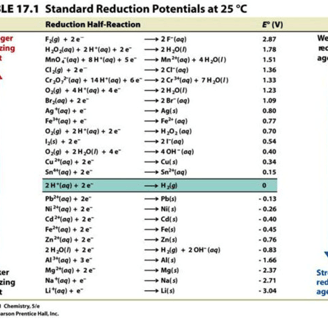
Por exemplo, o primeiro par redox flúor (F 2 ) é um agente oxidante forte. Se você medisse a diferença de voltagem entre F 2 e sua espécie reduzida fluoreto (ambos em uma concentração de 1 Molar), você obteria uma leitura de voltagem de 2,87 V.
Observe que o potencial de redução do hidrogênio: 2H + + 2e – => H 2 (g) é zero. Isso ocorre porque todos os valores redox são baseados no potencial de redução padrão para hidrogênio, que foi definido como zero. 3 Assim como o nível do mar é definido como elevação zero ou a água congela a 0 °C, a voltagem produzida por 1 MH + (pH 0) para H 2 (g) (pressão igual a 1 bar) é definida como zero. 3 Na verdade, é estimado em 4,44 ± 0,02 V a 25 °C, 4 mas o definimos como zero em todas as temperaturas. 3 Isso nos permite fazer comparações; por exemplo, a elevação de uma montanha, o ponto de ebulição do álcool ou o ORP de um par redox. Todas as reações redox são comparadas ao eletrodo de hidrogênio padrão ( SHE ). 2
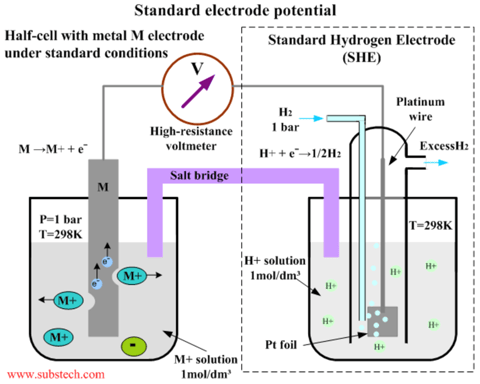
Este diagrama mostra como o potencial padrão E o de uma espécie (M) pode ser determinado. O eletrodo M contém espécies iônicas M em equilíbrio com as espécies não iônicas M. O potencial é referenciado ao eletrodo de hidrogênio padrão à direita.
MEDIDORES DE ORP
O medidor de ORP é geralmente um sistema de dois eletrodos (alguns podem ter um terceiro como um contra-eletrodo). Um é o eletrodo de platina chamado eletrodo de trabalho, onde ocorrem as reações de oxidação-redução. Ele serve como um doador de elétrons ou um aceitador de elétrons, dependendo da solução de teste. O outro é um eletrodo de referência (geralmente Ag/AgCl), que é calibrado de volta para o eletrodo de hidrogênio padrão. O eletrodo de referência é preenchido com uma solução saturada (3 M) de KCl. Este sistema de dois eletrodos faz uma medição potenciométrica medida em volts. 2
EQUAÇÃO DE NERNST
Em condições teóricas, o ORP pode ser previsto usando a equação de Nernst (eq 1) para a meia reação (eq 2)


Observe que se o casal redox H 2 (g) e os íons H + forem inseridos na equação de Nerst em condições padrão, então ln (1) é igual a zero, o que faz com que E seja zero porque E o é zero.
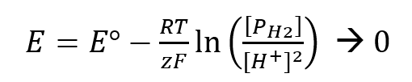
Medidores de ORP não são muito comuns entre aqueles na área de química, porque eles medem apenas o potencial da solução e não um íon ou molécula específica. Isso é especialmente verdadeiro com soluções que têm baixa condutividade e quando as concentrações dos pares redox são baixas.
Este é o caso quando os íons H 2 e H + são os pares redox, pois essas concentrações são relativamente pequenas na micro para nanoescala. Se o hidrogênio molecular for a espécie química de interesse, então o método preferido para teste é simplesmente medir a concentração de hidrogênio molecular.
REFERENCIAS
GONCHARUK, V. V., BAGRII, V. A., MEL’NIK, L. A., CHEBOTAREVA, R. D. & BASHTAN, S. Y. (2010). The use of redox potential in water treatment processes. Journal of Water Chemistry and Technology 32, 1-9.
Harris, Daniel C. Quantitative chemical analysis. Macmillan, 2010.
IUPAC Gold Book
Sergio Trasatti, “The Absolute Electrode Potential: an Explanatory Note (Recommendations 1986)”, International Union of Pure and Applied Chemistry, Pure & AppL Chem., Vol. 58, No. 7, pp. 955–66, 1986.
Contato
menu
Suporte
© 2024.TODOS DIREITOS RESERVADOS A VIVA A MAIS LTDA
